Durchbruch bei Entschlüsselung von Tollwut
Wissenschaftler der Vetmeduni Vienna gehen Struktur des Ribonukleoproteins auf den Grund
Wien (pte021/29.07.2019/11:30) Forscher der Veterinärmedizinischen Universität Wien (Vetmeduni Vienna) http://vetmeduni.ac.at haben erstmals ein genaues Bild der RNP-Struktur (Ribonukleoprotein) des Tollwutvirus (RABV) entschlüsselt. Laut den Wissenschaftlern handelt es sich um einen "bedeutenden Durchbruch" bei der Erforschung des für an Land lebenden Säugetieren hochgefährlichen Virus. Wird nicht unmittelbar zum Beispiel nach einem Biss reagiert, ist Tollwut auch beim Menschen unheilbar. Die WHO schätzt die jährliche Zahl der Todesopfer auf mehr als 55.000.
Kryoelektronentomografie genutzt
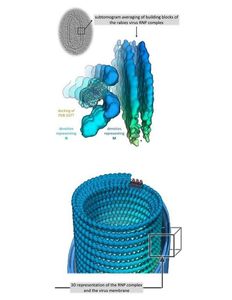
Das RABV-Partikel besteht aus einer von Zellen abgeleiteten Membran, in der mehrere Kopien des sogenannten Oberflächenglykoproteins verankert sind, und einem helikalen Ribonukleoprotein (RNP), das an einem Ende eine konische Spitze bildet. Obwohl die einzelnen Bauteile des RNP bereits bekannt waren, konnte die exakte Struktur des intakten RABV-RNP-Komplexes bisher nicht bestimmt werden. Genau das ist nun jedoch einem Team der Vetmeduni Vienna gelungen.
Mittels Kryoelektronentomografie - einem Verfahren zur Darstellung biologischer Strukturen - und einer daran anschließenden computerunterstützten Analyse haben die Forscher den Aufbau des Virus analysiert. Demnach besteht die Virusstruktur aus einer rechtshändigen Helix, die am 3'-Ende des Genoms im RNP-Konus lokalisiert ist, also gleich wie beim verwandten Virus der vesikulären Stomatitis (VSV), einer mild verlaufenden Viruskrankheit, die vor allem bei Huftieren auftritt und beim Menschen zu grippeähnlichen Symptomen führen kann.
"Erstaunliche strukturelle Variabilität"
"Die Verbindung benachbarter Helix-Windungen erfolgt beim Tollwutvirus allerdings über eine Interaktion des M-Proteins mit dem N-Protein, während eine M-M-Interaktion für VSV beschrieben wurde. Daraus resultiert - im Vergleich zu VSV - auch ein größerer Abstand der Helixwindungen zueinander und ein flacherer Winkel der einzelnen RNP-Windungen zur zentralen Virusachse", verdeutlicht Erstautorin Christiane Riedel.
Der Expertin nach demonstriert dies eine "erstaunliche strukturelle Variabilität des RNPs zwischen VSV und RABV", obwohl die schon bestimmten Kristallstrukturen der Einzelbausteine, also der N- und M-Proteine, strukturell stark homolog sind. Oder anders gesagt: "Obwohl die Einzelbausteine des Tollwutvirus und des VSV sehr ähnlich sind, unterscheiden sich die RNPs der beiden Viren deutlich in ihrer Architektur", so Riedel zu den zentralen Studienergebnissen.
(Ende)| Aussender: | pressetext.redaktion |
| Ansprechpartner: | Florian Fügemann |
| Tel.: | +43-1-81140-313 |
| E-Mail: | fuegemann@pressetext.com |
| Website: | www.pressetext.com |